Das Konzept von Hybridisierung ist definiert als der Prozess der Kombination zweier Atomorbitale, um eine neue Art hybridisierter Orbitale zu erzeugen. Diese Vermischung führt typischerweise zur Bildung von Hybridorbitalen mit völlig unterschiedlichen Energien, Formen usw. Die Hybridisierung erfolgt hauptsächlich durch Atomorbitale gleichen Energieniveaus. Allerdings können sowohl vollständig gefüllte als auch halbgefüllte Orbitale an diesem Prozess teilnehmen, wenn ihre Energien gleich sind. Das Konzept der Hybridisierung ist eine Erweiterung der Valenzbindungstheorie, die uns hilft, Bindungsbildung, Bindungsenergien und Bindungslängen zu verstehen.
Was ist Hybridisierung?
Wenn sich zwei Atomorbitale zu einem Hybridorbital in einem Molekül verbinden, wird die Energie der Orbitale einzelner Atome umverteilt, sodass Orbitale gleicher Energie entstehen. Dies wird als Hybridisierung bezeichnet.
Die Atomorbitale vergleichbarer Energie werden während des Hybridisierungsprozesses miteinander vermischt. Dabei handelt es sich meist um die Verschmelzung zweier Orbitale oder zweier „p“-Orbitale oder um die Vermischung eines „s“-Orbitals mit einem „p“-Orbital sowie einem „s“-Orbital. Orbital mit einem „d“-Orbital.
Hybridorbitale sind die neuen Orbitale, die als Ergebnis dieses Prozesses entstehen. Noch wichtiger ist, dass Hybridorbitale zur Erklärung der Atombindungseigenschaften und der Molekülgeometrie verwendet werden können. Kohlenstoff beispielsweise bildet vier Einfachbindungen, in denen sich das s-Orbital der Valenzschale mit drei p-Orbitalen der Valenzschale verbindet. Diese Kombination erzeugt vier äquivalente sp3Mischungen. Diese werden in einem tetraedrischen Muster um den Kohlenstoff angeordnet, der an vier verschiedene Atome gebunden ist.
Schritte zur Bestimmung der Art der Hybridisierung
Um die Art der Hybridisierung in einem Atom oder Ion zu verstehen, müssen die folgenden Regeln befolgt werden.
- Bestimmen Sie zunächst die Gesamtzahl der in einem Atom oder Ion enthaltenen Valenzelektronen.
- Zählen Sie dann die Anzahl der an dieses Atom oder Ion gebundenen freien Elektronenpaare.
- Nun kann die Anzahl der erforderlichen Orbitale berechnet werden, indem die Anzahl der Duplexe oder Oktette und die Anzahl der freien Elektronenpaare addiert werden.
- Es ist zu beachten, dass die Geometrie der Orbitale in Atomen oder Ionen anders ist, wenn kein einzelnes Elektronenpaar vorhanden ist.
Merkmale der Hybridisierung
- Die Hybridisierung erfolgt zwischen Atomorbitalen mit gleichen Energien.
- Die Anzahl der gebildeten Hybridorbitale entspricht der Anzahl der sich vermischenden Atomorbitale.
- Es ist nicht erforderlich, dass alle halbgefüllten Orbitale an der Hybridisierung teilnehmen. Auch vollständig gefüllte Orbitale mit leicht schwankender Energie können teilnehmen.
- Die Hybridisierung erfolgt nur während der Bindungsbildung, nicht in einem einzelnen Gasatom.
- Wenn die Hybridisierung des Moleküls bekannt ist, kann die Form des Moleküls vorhergesagt werden.
- Der größere Lappen des Hybridorbitals ist immer positiv, während der kleinere Lappen auf der gegenüberliegenden Seite immer negativ ist.
Typen der Hybridisierung
Hybridisierung kann als sp klassifiziert werden3, sp2, sp, sp3d, sp3D2, oder sp3D3basierend auf den Arten von Orbitalen, die an der Mischung beteiligt sind.
sp Hybridisierung
Es entsteht, wenn sich ein s- und ein p-Orbital in der Hauptschale eines Atoms zu zwei neuen äquivalenten Orbitalen verbinden. Die neu gebildeten Orbitale werden als sp-hybridisierte Orbitale bezeichnet. Es erzeugt lineare Moleküle im 180°-Winkel. Dabei werden das eigene Orbital und ein „p“-Orbital gleicher Energie kombiniert, um ein neues Hybridorbital zu erzeugen, das als sp-hybridisiertes Orbital bekannt ist.
- Es wird auch als diagonale Hybridisierung bezeichnet.
- Jedes sp-hybridisierte Orbital enthält die gleiche Anzahl an s- und p-Zeichen.
- Alle Berylliumverbindungen, wie z. B. BeF2, Also2, und BeCl2, sind Beispiele.

sp2Hybridisierung
Es entsteht, wenn sich ein s- und zwei p-Orbitale derselben Atomhülle zu drei äquivalenten Orbitalen verbinden. Die neu gebildeten Orbitale werden als sp bezeichnet2Hybridorbitale. Es ist auch als trigonale Hybridisierung bekannt. Dabei wird das eigene Orbital mit zwei „p“-Orbitalen gleicher Energie kombiniert, um ein neues Hybridorbital namens sp zu erzeugen2. Eine trigonale Symmetriemischung aus s- und p-Orbitalen wird bei 120 Grad gehalten. Alle drei Hybridorbitale bleiben in der gleichen Ebene und bilden miteinander einen 120°-Winkel.
- Jedes gebildete Hybridorbital hat einen 33,33 % und einen 66,66 % „p“-Charakter.
- Die Moleküle mit einer dreieckigen planaren Form haben ein Zentralatom, das mit drei anderen Atomen verbunden ist und sp2hybridisiert. Beispiele hierfür sind Borverbindungen.
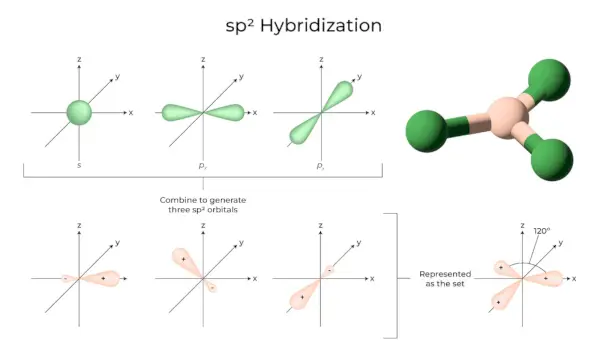
sp3Hybridisierung
Wenn sich ein „s“-Orbital und drei „p“-Orbitale aus derselben Atomhülle zu vier neuen äquivalenten Orbitalen verbinden, wird die Hybridisierung als tetraedrische Hybridisierung oder sp bezeichnet3. Die neu gebildeten Orbitale werden als sp bezeichnet3Hybridorbitale. Diese sind an den vier Ecken eines regelmäßigen Tetraeders zugespitzt und bilden miteinander einen Winkel von 109°28′.
- Die sp3Hybridorbitale bilden einen Winkel von 109,28 Grad.
- Jedes Hybridorbital hat einen 25 % s-Charakter und einen 75 % p-Charakter.
- Ethan und Methan sind zwei Beispiele.
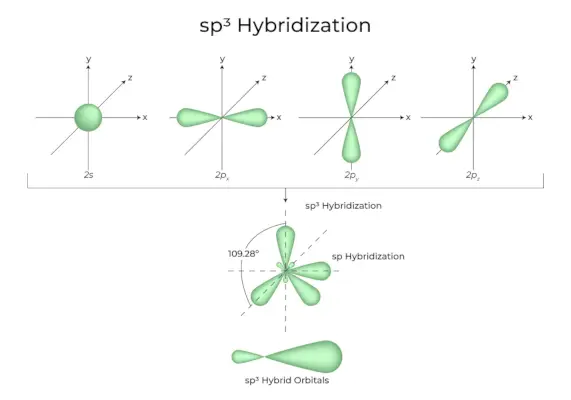
sp3d Hybridisierung
Die Mischung von 1s-Orbitalen, 3p-Orbitalen und 1d-Orbitalen führt zu 5 sp3d-hybridisierten Orbitalen gleicher Energie. Ihre Geometrie ist trigonal-bipyramidal. Die Kombination von s-, p- und d-Orbitalen führt zu einer trigonal-bipyramidalen Symmetrie. Bei den Äquatororbitalen handelt es sich um drei Hybridorbitale, die in einem Winkel von 120° zueinander ausgerichtet sind und in der horizontalen Ebene liegen.
- Die verbleibenden zwei Orbitale, sogenannte Axialorbitale, befinden sich in der vertikalen Ebene im 90-Grad-Winkel der Äquatorbitale.
- Hybridisierung beispielsweise in Phosphorpentachlorid (PCl5).
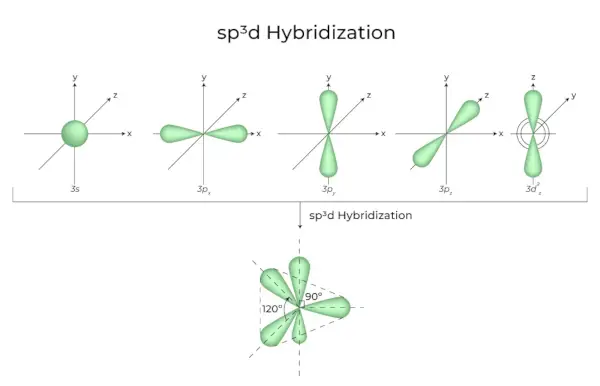
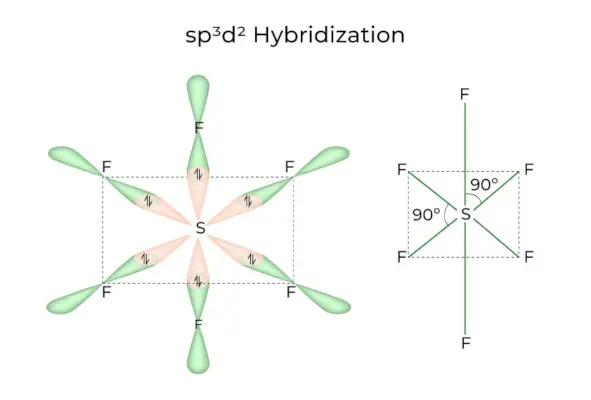
sp3D2 Hybridisierung
Wenn sich 1s-, 3p- und 2d-Orbitale zu 6 identischen sp verbinden3D2Hybridorbitale, die Hybridisierung wird sp genannt3D2Hybridisierung. Diese sieben Orbitale zeigen auf die Ecken eines Oktaeders. Sie sind im 90-Grad-Winkel zueinander geneigt.
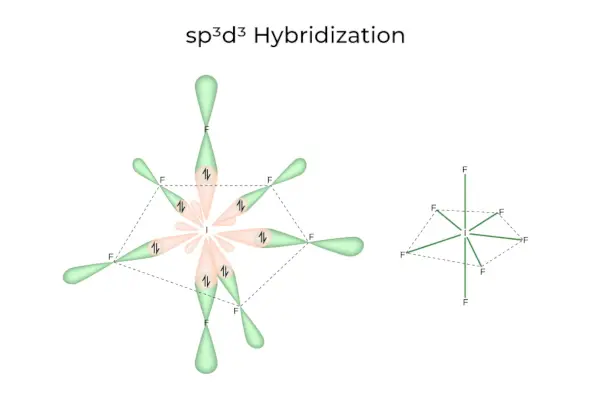
sp3D3Hybridisierung
Es verfügt über 1s-, 3p- und 3d-Orbitale, die zusammen sieben identische sp bilden3D3Hybridorbitale. Diese sieben Orbitale zeigen auf die Ecken einer fünfeckigen Bipyramide. z.B. WENN6.
Formen der Hybridisierung
- Linear: Die sp-Hybridisierung wird durch die Wechselwirkung von Zwei-Elektronen-Gruppen verursacht; der Umlaufwinkel beträgt 180°. Trigonal planar: Es sind drei Elektronengruppen beteiligt, was zu sp führt2Hybridisierung; Die Orbitale sind um 120° voneinander entfernt. Tetraedrisch: Vier Elektronengruppen sind beteiligt, was zu sp führt3Hybridisierung; der Umlaufwinkel beträgt 109,5°. Trigonal-bipyramidal: Fünf Elektronengruppen sind beteiligt, was zu sp führt3d Hybridisierung; Die Umlaufwinkel betragen 90° und 120°. Oktaedrisch: Sechs Elektronengruppen sind beteiligt, was zu sp führt3D2Hybridisierung; Die Orbitale sind um 90° voneinander entfernt.
FAQs zu Hybridisierung
Frage 1: Welches der Hybridorbitale von sp, sp2 und sp3 ist elektronegativer?
Antwort:
Der Prozentsatz des s-Zeichens in sp, sp2, und sp3hybridisierter Kohlenstoff beträgt 50 %, 33,33 % bzw. 25 %. Aufgrund der Kugelform des s-Orbitals wird es vom Kern gleichmäßig aus allen Richtungen angezogen. Infolgedessen liegt ein Hybridorbital mit S-Charakter näher am Kern und ist daher elektronegativer. Infolgedessen ist der sp-hybridisierte Kohlenstoff am elektronegativsten.
Frage 2: Was sind Hybridorbitale?
Antwort:
Hybridorbitale entstehen durch die Kombination von Standard-Atomorbitalen und führen zur Bildung neuer Atomorbitale.
Vernetzung und Typen
Frage 3: Welche fünf Formen der Hybridisierung gibt es?
Antwort:
Linear, trigonal-planar, tetraedrisch, trigonal-bipyramidal und oktaedrisch sind die fünf Grundformen der Hybridisierung.
Frage 4: Warum sieht das Amidmolekül wie sp aus?3hybridisiert, ist aber sp2?
Antwort:
Wenn das Atom entweder von zwei oder mehr p-Orbitalen umgeben ist oder über ein freies Elektronenpaar verfügt, das in ein p-Orbital springen kann, ändert sich der allgemeine Hybridisierungsprozess. Infolgedessen tritt im Fall eines Amidmoleküls das freie Elektronenpaar in ein p-Orbital ein, was zu drei benachbarten parallelen p-Orbitalen führt.
Frage 5: Was ist Bents Regel?
Antwort:
Ein Zentralatom, das mit zahlreichen Gruppen in einem Molekül verbunden ist, hybridisiert, wodurch Orbitale mit mehr s-Charakter auf elektropositive Gruppen und Orbitale mit mehr p-Charakter auf elektronegative Gruppen gerichtet werden.
