Base ist eine chemische Verbindung, die aus OH besteht–Ionen und nimmt Protonen auf. Basen sind in der Chemie jene Verbindungen, die roten Lackmus blau färben und bei Reaktion mit Säure die Reaktion neutralisieren, wodurch Salz und Wasser entsteht. Der pH-Wert der Base liegt über 7. Basen schmecken bitter und fühlen sich glitschig an. Die wasserlöslichen Basen werden Alkalien genannt. Beispiele für Basen sind Metalloxide, Metallhydroxide usw. Seife ist ein Beispiel für eine Base, die wir im täglichen Leben verwenden. In diesem Artikel lernen wir die Definition, Eigenschaften und chemischen Reaktionen von Basen im Detail kennen.

Basisdefinition
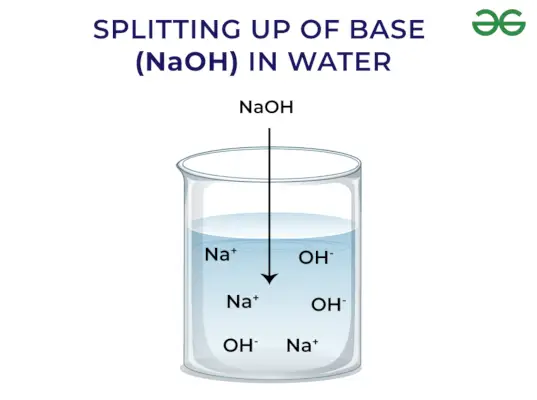
Base ist definiert als die chemische Verbindung, deren pH-Wert größer als 7 ist, ein Proton aufnimmt, Säure neutralisiert und roten Lackmus in Blau umwandelt. Sie setzen im Allgemeinen OH frei–Ion bei Dissoziation. Beispiele hierfür sind NaOH, NaHCO3,usw. Im Folgenden sind einige allgemeine Merkmale der Basis aufgeführt:
- Sie haben einen bitteren Geschmack
- Bei Berührung sind sie rutschig
- Sie färben roten Lackmus blau
- Sie befreien OH–Ion, wenn es in Wasser gelöst wird
- Sie leiten Strom in Lösungsform
Basen gehören zu den wichtigsten chemischen Verbindungen, die im täglichen Leben verwendet werden. Basen werden als Antazida zur Kontrolle des Säuregehalts und in Zahnpasta verwendet, um die bakterielle Wirkung zu neutralisieren, die in unserem Mund Säure produziert und den Abbau von Zahnschmelz und Hohlräumen verhindert. Sie werden auch als Backpulver, Natron und Waschpulver verwendet.
Lewis-Basis
Lewis-Basen sind Verbindungen mit Elektronenpaaren, die sie an Verbindungen abgeben können, denen es an Elektronenpaaren mangelt. Lewis-Basen sind von Natur aus nukleophil, d. h. sie sind kernliebend, was bedeutet, dass sie mit ihren Elektronenpaaren ein positiv geladenes Zentrum angreifen. Beispiele für Lewis-Basen sind Ammoniak, da in Ammoniak (NH3) Das Mittelatom Stickstoff hat 5 Elektronen, von denen 3 zur Bildung von Bindungen mit 3 Wasserstoffatomen verwendet werden und ein Elektronenpaar beim N-Atom verbleibt, wodurch NH entsteht3eine Lewis-Basis.
Arrhenius-Basis
Nach dem Konzept von Arrhenius sind Basen Verbindungen, die beim Auflösen in Wasser Hydroxidionen freisetzen und die Konzentration der Hydroxylionen in der wässrigen Lösung erhöhen. Wenn beispielsweise KOH in Wasser gelöst wird, entsteht OH–Ion und erhöhen so die Konzentration von OH–im Wasser.
Bronsted-Basis
Das Bronsted-Basenkonzept ist eine erweiterte Version des Arrhenius-Konzepts, das besagt, dass Basen Verbindungen sind, die H akzeptieren+Ion oder Proton, um ihre konjugierte Säure zu bilden. Zum Beispiel Cl–ist eine Base, die H akzeptiert+um HCl als konjugierte Säure zu bilden.
Arten von Basen
Basen können nach Säuregehalt, Konzentration und Ionisierungsfähigkeit klassifiziert werden. Die Klassifizierung ist unten aufgeführt
Arten von Basen basierend auf dem Säuregehalt
Der Säuregehalt einer Base bezieht sich auf die Anzahl der austauschbaren Hydroxylgruppen, die in einem Molekül der Base vorhanden sind. Basierend auf dem Säuregehalt werden Basen in drei Kategorien eingeteilt:
- Monosaure Base
- Disäurebasis
- Trisaure Base
Monosauer: Monosaure Basen sind solche, die nur ein austauschbares Hydroxylion enthalten und mit nur einem Wasserstoffion interagieren. Zu den einsäurehaltigen Basen gehören NaOH, KOH und andere.
Disäurehaltig: Eine zweisaure Base ist eine Base mit zwei austauschbaren Hydroxylionen, die mit zwei Wasserstoffionen interagieren. Ca(OH)2, Mg(OH)2und andere zweisaure Basen sind Beispiele.
Trisauer: Trisaure Base ist eine Basenart, die aus drei austauschbaren Hydroxylionen und drei Wasserstoffionen besteht. Zu den dreisauren Basen gehören Al(OH)3, Fe(OH)3, und andere.
Arten von Basen basierend auf ihrer Konzentration in wässriger Lösung
Die Konzentration bezieht sich auf die Menge der Base, die in einer wässrigen Lösung vorhanden ist. Basierend auf ihrer Konzentration in wässriger Lösung werden Basen in zwei Kategorien eingeteilt:
- Konzentrierte Basis
- Verdünnte Basis
Konzentrierte Basis: Konzentrierte Basen sind solche, bei denen der Basenanteil im Vergleich zum Lösungsmittel groß ist. Konzentrierte NaOH-Lösung zum Beispiel.
ls-Befehle unter Linux
Verdünnte Basis: Diese Basentypen weisen eine geringere Basenkonzentration in ihrer wässrigen Lösung auf. Bei der Verdünnung wird der Anteil eines gelösten Stoffes durch Zugabe einer größeren Menge Lösungsmittel verringert. Verdünnen Sie beispielsweise NaOH, verdünnen Sie KOH usw.
Basentypen basierend auf dem Ionisationsgrad
Der Ionisierungsgrad bezieht sich auf die Fähigkeit einer chemischen Verbindung, beim Auflösen in Wasser ihre Ionbestandteile freizusetzen. Im Fall einer Base bezieht sich der Ionisierungsgrad auf die Fähigkeit der Base, OH freizusetzen–Ionen, wenn sie in Wasser gelöst werden. Basierend auf dem Ionisationsgrad werden Basen in zwei Typen eingeteilt:
- Starke Basis
- Schwache Basis
Starke Basis: Starke Basen sind solche Basen, die beim Auflösen in Wasser vollständig dissoziieren und OH-Ionen freisetzen. Einige Beispiele für starke Basen sind NaOH, KOH usw.
Schwache Basis: Die Basen, die keine vollständige Dissoziation eingehen und nur einen Bruchteil des OH-Ions freisetzen, werden als schwache Base bezeichnet. Beispiele für schwache Basen sind Al(OH)3,Cu(OH)2,usw.
Erfahren Sie mehr, Starke und schwache Basen
Eigenschaften von Basen
Wie wir wissen, handelt es sich bei Basen um chemische Verbindungen mit OH-Ionen, die roten Lackmus blau färben usw. In diesem Abschnitt erfahren Sie mehr über die physikalischen und chemischen Eigenschaften von Basen sowie einige kurze Kenntnisse über ihre allgemeinen Eigenschaften.
Allgemeine Eigenschaften der Base
Die allgemeinen Eigenschaften von Basen sind unten aufgeführt:
- Ein Hydroxidion (OH–) wird durch Basen ins Wasser abgegeben. Je stärker die Base wird, desto mehr Ionen werden freigesetzt.
- Basen reagieren mit Säure unter Bildung von Salzen. Säuren reagieren mit Basen. Diese Reaktion einer Base mit einer Säure wird Neutralisationsreaktion genannt.
- Basen verfärben roten Lackmus blau.
- Die Struktur eines Proteins kann durch Basen verändert werden. Basen haben diese Qualität, wodurch sie sich glatt anfühlen. Seife ist eine Basis, die im nassen Zustand unglaublich rutschig auf der Haut wird. Aufgrund ihrer Fähigkeit, die Struktur von Proteinen zu verändern, sind einige starke Basen äußerst gefährlich.
Physikalische Eigenschaften von Basen
Basen schmecken Bitter: Basen haben einen bitteren Geschmack. Aufgrund seiner Bitterkeit gibt es bei uns nur wenige basische Lebensmittel. Es gibt nur wenige alkalische Lebensmittelmaterialien. Basen müssen im Vergleich zu Säuren mit größerer Vorsicht verkostet werden.
Basen sind bei Kontakt rutschig: Bei Berührung fühlen sich die Basen rutschig an. Zum Beispiel Seife.
Basen setzen OH frei – Ion: Wenn Basen in Wasser gelöst werden, setzen sie Hydroxylionen (OH) frei–). Abhängig von der Fähigkeit, Hydroxylionen freizusetzen, werden sie in stark und schwach eingeteilt.
Basen neutralisieren Säuren: Wenn Basen mit Säuren reagieren, neutralisieren sie sich gegenseitig und erzeugen Salz und Wasser. Diese Reaktion wird aufgerufen Neutralisierungsreaktion . Nehmen wir an, wir haben die Säure HY und die Base „XOH“, dann ist das gebildete Salz „XY“. Die Gleichung für diese Reaktion kann als HY + XOH → HOH + XY angegeben werden.
Basen Denaturieren Protein: Unter Denaturierung von Proteinen versteht man die Zerstörung der Stabilität und Struktur des Proteins. Dadurch ist die Verwendung von Basen für den Menschen schädlich, da menschliche Haut und Haare aus Proteinen bestehen und starke Alkalien wie Natrium- oder Kaliumhydroxid, auch Laugen genannt, schädliche Auswirkungen auf die menschliche Haut haben.
Basen verwandeln roten Lackmus in blaues: Wenn Basen mit rotem Lackmus in Kontakt gebracht werden, färben sie ihn blau. Es sollte jedoch beachtet werden, dass keine solche Veränderung beobachtet werden kann, wenn wir versuchen, trockene Basis mit rotem Lackmuspapier zu reagieren. Der Lackmuspapiertest ist eine der ältesten Methoden zum Testen von Grundlagen. Es gibt jedoch auch andere Indikatoren wie Phenolphthalein
Basen leiten Strom: Wenn Basen in gelöster Form vorliegen, verfügen sie über bewegliche OH-Ionen und können daher Elektrizität leiten.
Chemische Eigenschaften von Basen
- Reaktion der Base mit Metallen: Wenn Alkali (Base) mit Metall reagiert, entsteht Salz und Wasserstoffgas.
Alkali + Metall → Salz + Wasserstoff
Beispiele:
- Wenn Natriumhydroxid mit Aluminiummetall interagiert, entstehen Natriumaluminat und Wasserstoffgas.
2 NaOH + 2 Al + 2 H 2 O → 2 NaAlO 2 + 2 Std 2
- Wenn Natriumhydroxid mit Zinkmetall interagiert, entstehen Wasserstoffgas und Natriumzinkat.
2 NaOH + Zn → Na 2 ZnO 2 + H 2
- Reaktion nichtmetallischer Oxide mit Base: Salz und Wasser entstehen, wenn nichtmetallische Oxide mit einer Base reagieren.
Nichtmetallisches Oxid + Base → Salz + Wasser
Bei Calciumhydroxid wird eine Base mit Kohlendioxid reagiert, dann entstehen Calciumcarbonat und Wasser.
Ca(OH) 2 + CO 2 → CaCO 3 + H 2 Ö
- Reaktion von Alkalien/Basen mit Ammoniumsalzen: Ammoniak entsteht, wenn Alkalien mit Ammoniumsalzen reagieren.
Alkali + Ammoniumsalz → Salz + Wasser + Ammoniak
Wenn Calciumhydroxid mit Ammoniumchlorid reagiert, entstehen Calciumchloridwasser und Ammoniak.
Ca(OH) 2 + NH 4 Cl → CaCl 2 + H 2 O + NH 3
Beispiele für Basen
Basen sind im Allgemeinen Metalloxide, Metallhydroxide, Metallhydrogencarbonate, Metallcarbonate usw. Sehen wir uns einige Beispiele für Basen mit ihrer Anwendung in tabellarischer Form an:
| Basen | Anwendungen |
|---|---|
| Kaliumhydroxid KOH | Wird in Alkalibatterien verwendet |
| Natriumhydroxid NaOH | Wird bei der Herstellung von Seife und Reinigungsmitteln verwendet |
| Magnesiumhydroxid Mg(OH) 2 | Wird als Antazida verwendet |
| Natriumbicarbonat NaHCO 3 | Wird als Backpulver verwendet |
| Natriumcarbonat Bereits 2 CO 3 | Wird als Waschsoda verwendet |
| Ammoniak NH 3 | Wird bei der Herstellung von Reinigungs- und Pharmaprodukten verwendet |
| Kalziumhydroxid Ca(OH) 2 | Wird beim Weißwaschen verwendet Java instanziiert |
Verwendung von Basen
Es gibt verschiedene Anwendungsfälle von Base, einige davon sind:
- Natriumhydroxid wird bei der Herstellung von Seife und Papier verwendet. Natriumhydroxid (NaOH) wird auch bei der Herstellung von Viskose verwendet.
- Bleichpulver wird aus Ca(OH) hergestellt2, allgemein bekannt als gelöschter Kalk oder Calciumhydroxid.
- Calciumhydroxid wird zur Herstellung von Trockenmischungen zum Malen und Dekorieren verwendet.
- Magnesiumhydroxid, im Volksmund als Magnesiamilch bekannt, ist ein häufig verwendetes Abführmittel. Es wird auch als Antazidum verwendet, da es den Übersäuregehalt im menschlichen Magen verringert.
- In Laboratorien ist Ammoniumhydroxid ein kritisches Reagenz.
- Gelöschter Kalk kann verwendet werden, um überschüssige Säure im Boden zu neutralisieren.
Mehr lesen
- Säure, Base und Salz
- Stärke der Säure
- Ionisierung von Säure und Base
FAQs zu Basen in der Chemie
1. Was sind Basen?
- Basische Verbindungen haben einen bitteren Geschmack.
- Die Textur der meisten Basen ist seifig.
- Beim Test auf Lackmuspapier wandelt es in den meisten Fällen rotes Lackmuspapier in blaues Lackmuspapier um.
- In Lösung leiten die Basenverbindungen auch Strom.
- Beim Auflösen basischer Verbindungen in Wasser werden OH-Ionen freigesetzt.
2. Welche Funktionen haben Basen?
Zu Hause verwenden wir Basen als Reinigungsmittel und Antazida. Seifen, Lauge (die in Ofenreinigern verwendet wird), Magnesiamilch und Tums sind Beispiele für beliebte hausgemachte Basen. Jeder von ihnen hat einen pH-Wert von mehr als sieben, kann freien Wasserstoff verbrauchen und Säuren neutralisieren.
3. Was ist der wichtigste Unterschied zwischen einer Säure und einer Base?
Säuren und Basen sind zwei Arten von ätzenden Chemikalien. Saure Materialien haben einen pH-Wert zwischen 0 und 7, während Basen einen pH-Wert zwischen 7 und 14 haben. Säuren sind ionische Chemikalien, die in Wasser zerfallen und das Wasserstoffion (H+) erzeugen, während die Base unter Bildung des OH--Ions dissoziiert.
4. Was sind die physikalischen Eigenschaften von Basen?
- Sie haben einen bitteren Geschmack.
- Ihre wässrigen Lösungen haben eine seifige Qualität.
- Sie verändern die Farbe von Lackmuspapier von Rot zu Blau.
- Ihre wässrigen Lösungen sind elektrisch leitfähig.
- Unter Freisetzung von Wasserstoffgas reagieren Basen mit Metallen unter Bildung von Salzen.
5. Was passiert, wenn Calciumhydroxid mit Ammoniumchlorid reagiert?
Wenn Calciumhydroxid mit Ammoniumchlorid reagiert, entstehen Calciumchloridwasser und Ammoniak.
Ca(OH) 2 + NH 4 Cl → CaCl 2 + H 2 O + NH 3
6. Was passiert, wenn Natriumhydroxid mit Zinkmetall reagiert?
Wenn Natriumhydroxid mit Zinkmetall interagiert, entstehen Wasserstoffgas und Natriumzinkat.
2 NaOH + Zn → Na 2 ZnO 2 + H 2
7. Was ist Lewis-Base?
Lewis-Basen sind Verbindungen, die ein Elektronenpaar an die elektronenarme Verbindung abgeben. Beispiel beinhaltet NH3.
8. Woraus bestehen Basen?
Basen bestehen im Allgemeinen aus OH–Ion. Neben diesen Metalloxiden zählen auch Carbonate und Hydrogencarbonate zu den Basen.
9. Was sind Alkalien?
Die wasserlöslichen Basen werden Alkalien genannt. Ein Beispiel ist Natriumhydroxid NaOH.
10. Was sind starke Basis und schwache Basis?
Die Basen dissoziieren vollständig zu OH–Ionen beim Auflösen in Wasser werden als starke Base bezeichnet. Beispiele hierfür sind NaOH. Schwache Basen sind solche, die nicht vollständig dissoziieren und OH freisetzen–Das Ion wird als schwache Base bezeichnet. Beispiele für schwache Basen sind Ammoniumhydroxid.
