Atomorbitale , das sind mathematische Funktionen, beschreiben das Wellenverhalten von Elektronen (oder Elektronenpaaren) in einem Atom. Atomorbitale haben je nach Typ unterschiedliche Formen. Die unterschiedlichen Formen der Atomorbitale beschreiben, dass die Wahrscheinlichkeit, in bestimmten Richtungen ein Elektron um den Kern herum zu finden, entweder am höchsten oder bei null liegt. Es gibt vier Arten von Orbitalen, die jeweils eine andere Form haben und durch die Buchstaben s, p, d und f dargestellt werden. Die s- und p-Orbitale werden berücksichtigt, da sie in der chemischen und biologischen Chemie am häufigsten vorkommen. Ein s-Orbital hat einen kugelförmigen Kern in der Mitte, a p-Orbital ist hantelförmig und vier der fünf d-Orbitale sind kleeblattförmig. Das fünfte d-Orbital hat die Form einer langen Hantel mit einem Donut in der Mitte. Die Orbitale eines Atoms sind in Schichten oder Elektronenhüllen organisiert.
Was sind Atomorbitale?
Atomorbitale sind der dreidimensionale Raum in der Nähe des Atomkerns, in dem die Möglichkeit, ein Elektron zu entdecken, am größten ist.
Ein Atom kann nach dem Quantenatommodell unendlich viele Orbitale haben. Diese Orbitale können anhand ihrer Größe, Form oder Ausrichtung klassifiziert werden. Ein engeres Orbital bedeutet, dass die Wahrscheinlichkeit größer ist, ein Elektron in der Nähe des Kerns einzufangen. Die Orbitalwellenfunktion wird oft als mathematische Funktion bezeichnet, die verwendet wird, um die Koordinaten eines Elektrons auszudrücken. Die Wahrscheinlichkeit, ein Elektron zu lokalisieren, wird durch das Quadrat der Orbitalwellenfunktion dargestellt. Diese Wellenfunktion hilft auch bei der Erstellung von Grenzflächendiagrammen.
Orbitalwellenfunktion
Der Quantenatommodell sagt voraus, dass ein Atom eine große Vielfalt an Orbitalen haben kann. Diese Orbitale können nach ihrer Größe, Geometrie oder Neigung gruppiert werden. Eine verringerte Orbitalgröße erhöht die Wahrscheinlichkeit, ein Elektron in der Nähe des Kerns zu erhalten. Die mathematische Funktion zur Darstellung der Koordinaten eines Elektrons heißt Orbitalwellenfunktion . Die Wahrscheinlichkeit, ein Elektron zu entdecken, wird durch das Quadrat der Orbitalwellenfunktion dargestellt.
Wir können diese Wellenfunktion auch verwenden, um Grenzflächendiagramme zu erstellen. Wir können die Form von Orbitalen besser verstehen, indem wir Grenzflächendiagramme der konstanten Wahrscheinlichkeitsdichte für verschiedene Orbitale verwenden.
Hadoop-Tutorial
Formen von Atomorbitalen
Die Formen der Atomorbitale variieren. Das heißt, die Wahrscheinlichkeitsverteilungen der Elektronen, die sie in der Umgebung des Kerns beschreiben, sind unterschiedlich. Die Tatsache, dass sich die Elektronen in verschiedenen Orbitalen wahrscheinlich in unterschiedlichen Bereichen um den Mutterkern befinden und daher dessen Anziehung unterschiedlich stark erfahren, ist einer der Gründe dafür, dass die Energie der Orbitale schwankt. Es ist erstaunlich, dass alle Orbitale in einer bestimmten Hülle des Wasserstoffatoms die gleiche Energie haben, aber unterschiedliche Formen haben. Dies ist auf den Wegfall verschiedener energiebedingter Beiträge zurückzuführen.
Sobald aber ein zweites Elektron da ist, verschwindet die Entartung.
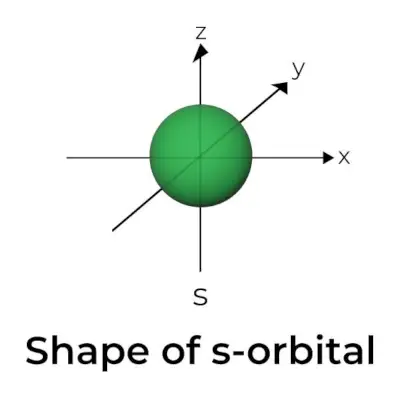
Form des S-Orbitals
- Das s-Bahngrenzflächendiagramm ähnelt einer Kugel mit dem Kern in der Mitte, die in zwei Dimensionen als Kreis dargestellt werden kann.
- s-Orbitale sind sphärisch symmetrisch, was bedeutet, dass die Wahrscheinlichkeit, ein Elektron in einem bestimmten Abstand zu finden, in alle Richtungen gleich ist.
- Es wird ebenfalls gezeigt, dass die Größe des s-Orbitals mit zunehmendem Wert der Primärquantenzahl (n) zunimmt; daher 4s> 3s> 2s> 1s.
- Der Knotenpunkt ist ein Ort, an dem es keine Chance gibt, das Elektron zu lokalisieren. Knoten werden in zwei Typen eingeteilt: Radialknoten und Winkelknoten. Der Abstand vom Kern wird durch die Radialknoten berechnet, während die Ausrichtung durch die Winkelknoten bestimmt wird.
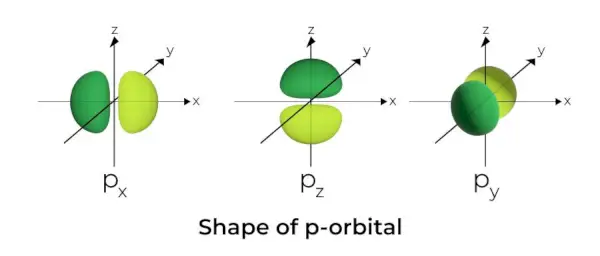
Form des p-Orbitals
- Die p-Orbitale haben die Form von Hanteln.
- Der p-Orbitalknoten befindet sich im Zentrum des Kerns.
- Aufgrund der Anwesenheit von drei Orbitalen kann das p-Orbital maximal sechs Elektronen besetzen.
- Jedes p-Orbital besteht aus zwei Teilen, die als Lappen bezeichnet werden und sich auf beiden Seiten der Ebene befinden, die durch den Kern verläuft.
- Jedes p-Orbital hat Teile, die als Lappen bezeichnet werden, auf beiden Seiten der Ebene, die durch den Kern verläuft. In der Ebene, in der sich die beiden Lappen schneiden, ist die Wahrscheinlichkeit, ein Elektron zu finden, gleich Null.
- Die drei Orbitale werden als entartete Orbitale bezeichnet, da sie die gleiche Größe, Form und Energie haben.
- Der einzige Unterschied zwischen den Orbitalen besteht in der Ausrichtung der Lappen. Da die Lappen entlang der x-, y- oder z-Achse ausgerichtet sind, erhalten sie die Bezeichnung 2px, 2py, und 2pz. Zur Berechnung der Anzahl der Knoten wird die Formel n –2 verwendet.
- Ähnlich wie bei s-Orbitalen steigen Größe und Energie von p-Orbitalen mit zunehmender Primärquantenzahl (4p> 3p> 2p).
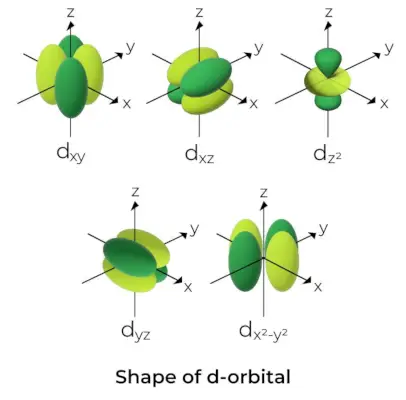
Form des d-Orbitals
- Für d-Orbitale wird die magnetische Orbitalquantenzahl als (-2,-1,0, 1,2) angegeben. Daher können wir behaupten, dass es fünf d-Orbitale gibt.
- Diese Orbitale werden mit den Symbolen d bezeichnetxy, Dyz, Dxz, DX2-Und2, und dMit2.
- Die Formen der ersten vier d-Orbitale sind einander ähnlich, was sich von den d-Orbitalen unterscheidetMit2Orbital, aber die Energie aller fünf d-Orbitale ist gleich.
Form des f-Orbitals
- Die Form des f-Orbitals ist gestreut. Da der Wert l = 3 für das f-Orbital ist, beträgt der Minimalwert der Primärquantenzahl n 4.
- Die entsprechenden ml-Werte für das f-Orbital sind (-3,–2, –1, 0, +1, +2, +3).
- Folglich gibt es sieben f-Orbitale für l = 3.

Was ist Desktop-INI?
Entartete Orbitale
Entartete Orbitale sind solche mit gleicher Energie. Diese Orbitale sind unterschiedlich (sie können im Raum um sie herum unterschiedlich ausgerichtet sein). Atomkern ), aber sie haben die gleiche Energie. In Gegenwart eines externen Feldes bleibt die Entartung des p-Orbitals unberührt; Die Entartung der f- und d-Orbitale kann jedoch gebrochen werden, indem ein externes Feld (entweder ein elektrisches oder ein magnetisches Feld) an das System angelegt wird.
Nur wenige Orbitale werden eine höhere Energie haben, während andere eine niedrigere Energie haben. Es wird keine Entartung mehr im System geben. Beispielsweise bestehen d-Orbitale aus fünf entarteten Orbitalen, die alle die gleiche Energie haben.
Mehr lesen:
- Molekülorbitaltheorie
- Füllung des Orbitals in einem Atom
- Hybridisierung
FAQs zu Formen von Atomorbitalen
Frage 1: Wie funktionieren Orbitale?
Antwort:
Ein Atomorbital ist ein mathematischer Ausdruck, der in der Atomtheorie und Quantenmechanik das wellenartige Verhalten eines Elektrons oder eines Elektronenpaars in einem Atom ausdrückt. Jedes Orbital nimmt maximal zwei Elektronen mit jeweils eigenem Spin auf.
Frage 2: Was ist eine Knotenebene?
Antwort:
np.concatenate
Die Ebene, in der die Wahrscheinlichkeit, ein Elektron zu finden, vernachlässigbar oder Null ist, wird Knotenebene genannt.
Frage 3: Wie viele Orbitale gibt es?
Antwort:
in Ordnung
Da die s-Unterebene nur ein Orbital hat, können nur zwei Elektronen vorhanden sein. Da die p-Unterebene aus drei Orbitalen besteht, können maximal sechs Elektronen vorhanden sein. Da die d-Unterebene aus 5 Orbitalen besteht, können maximal 10 Elektronen vorhanden sein. Und jede der vier Unterebenen verfügt über sieben Orbitale, die maximal 14 Elektronen aufnehmen können.
Frage 4: Welche Orbitale haben die höchste Energie?
Antwort:
Pyspark
Das Orbital 1s hat die meiste Energie. Die Energie eines Elektrons ist die Energiemenge, die erforderlich ist, um es aus der elektrischen Blase des Atoms herauszuholen.
Frage 5: Was ist der Unterschied zwischen einer Hülle und einem Orbital?
Antwort:
In einem Atom ist eine Schale eine Ansammlung von Unterschalen derselben Quantenzahlentheorie n. Orbitale haben jeweils zwei Elektronen, und Elektronen im selben Orbital haben die gleiche Definition von Größe, Drehimpulsgröße und magnetischer Quantenzahl.
Frage 6: Was ist die Sigma- und Pi-Bindung?
Antwort:
Durch die Überlappung der Atomorbitale entstehen Sigma- und Pi-Bindungen. Sigma-Bindungen entstehen durch Überlappung atomarer Orbitallappen, während Pi-Bindungen entstehen, wenn ein atomarer Orbitallappen einen anderen überlappt.
