Das Aufbauprinzip ist die grundlegende Methode, die uns sagt, wie die Elektronen im Atomorbital gefüllt sind. Nach dem Aufbauprinzip folgt die Besetzung der Elektronen im Grundzustand eines Atoms einem Grundmuster. Dieses Prinzip besagt, dass die Elektronen im Atomorbital eines beliebigen Atoms in aufsteigender Reihenfolge ihrer Energie gefüllt werden und dass sie zur Ermittlung der Energie des Atomorbitals der n+l-Regel folgen.
Aufbau Principle
In diesem Artikel lernen wir das Aufbau-Prinzip, die Merkmale des Aufbau-Prinzips sowie seine Ausnahmen und Einschränkungen im Detail kennen.
Aufbau Principle Definition
Aufbau’s Principle states that
Elektronen in verschiedenen Orbitalen werden in aufsteigender Reihenfolge ihrer Energie besetzt, d. h. das Orbital mit der niedrigsten Energie wird zuerst und das Orbital mit der höchsten Energie zuletzt gefüllt.
Das Wort „Aufbau“ bedeutet auf Deutsch „Aufbauen“. Unter Bildung von Orbitalen versteht man das Auffüllen von Orbitalen mit Elektronen. Es besagt, dass die Elektronen in Atomorbitalen in aufsteigender Reihenfolge der Energie des Atomorbitals gefüllt sind. Und die Energie des Atomorbitals wird mithilfe der n+l-Regel berechnet, die angibt, ob das Elektron mit einer höheren Zahl des n+l-Werts die höhere Energie hat. In der in der vorherigen Zeile besprochenen Regel gilt: N gibt die Hauptquantenzahl an und l gibt die azimutale Quantenzahl an.
Wenn zwei Elektronen den gleichen Wert von n+l haben, dann ist das Elektron mit einem kleineren Wert von N hat die kleinere Energie und wird zuerst gefüllt. Die Reihenfolge der Besetzung der Elektronen in einem Atomorbital wird unten diskutiert.
Aufbau Principle Diagram
Das Aufbau-Prinzip-Diagramm ist das Diagramm, das die Reihenfolge der Besetzung der Elektronen in einem Atom darstellt.
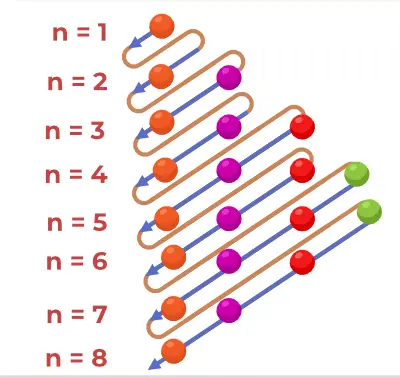
Aufbau Principle Diagram
Aufbau Principle Formula
Die Aufbau-Prinzip-Formel ist die Formel, die die Reihenfolge angibt, in der die Elektronen in das Atomorbital eingefüllt werden. Die Atomorbitalformel lautet
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p…….
Aufbau Principle Class 11
Das Aufbauprinzip ist ein wichtiges Prinzip der Chemie für die Schüler der 11. Klasse. Dieses Prinzip besagt, dass
Die Elektronen im Atomorbital eines Atoms werden in aufsteigender Reihenfolge der Energie des Atomorbitals gefüllt, die mithilfe der (n+l)-Regel berechnet wird.
Drawing the Aufbau Diagram
Das Aufbaudiagramm wird mit den unten hinzugefügten Schritten erstellt.
- Finden Sie die Anzahl der Elektronen, die in die Atome gefüllt werden sollen.
- Wir wissen, dass in einem Atom die
- Das s-Orbital kann maximal 2 Elektronen aufnehmen.
- Das p-Orbital kann maximal 6 Elektronen aufnehmen.
- Das d-Orbital kann maximal 10 Elektronen aufnehmen.
- Das f-Orbital kann maximal 14 Elektronen aufnehmen.
- Füllen Sie die ersten beiden Elektronen im 1s-Orbital aus.
- Befolgen Sie dann die n+l-Regel und füllen Sie dann die Elektronen entsprechend auf.
Salient Features of Aufbau Principle
Verschiedene Merkmale des Aufbauprinzips sind:
Multiplexer
- Die Energie eines Orbitals hängt von der Summe der Werte der Hauptquantenzahl (n) und der azimutalen Summenzahl (I) ab. Dies nennt man (n + l)-Regel . Nach dieser Regel gilt
- In einem neutralen isolierten Atom ist seine Energie umso geringer, je niedriger der Wert von (n + l) für ein Orbital ist. Wenn jedoch zwei verschiedene Arten von Orbitalen den gleichen Wert (n + l) haben, dann haben die Orbitale mit einem niedrigeren n-Wert weniger Energie.
| Art des Orbitals | Wert von n | Wert von l | Wert von n+l | Relative Energie |
|---|---|---|---|---|
| 1s | 1 | 0 | 1+0 = 1 | Niedrigste Energie |
| 2s | 2 | 0 | 2+0 = 2 | Höhere Energie als 1s Orbital |
| 14 Uhr 3s | 2 3 | 1 0 | 2+1 = 3 3+0 = 3 | 2p-Orbitale (n=2) haben eine niedrigere Energie als 3s-Orbitale (n=3). |
| 15 Uhr 4s | 3 4 | 1 0 | 3+1 = 4 4+0 = 4 | 3p-Orbitale (n=3) haben eine niedrigere Energie als 4s-Orbitale (n=4). |
| 3d 16 Uhr | 3 4 | 2 1 | 3+2 = 5 4+1 = 5 | 3d-Orbitale (n=3) haben eine niedrigere Energie als 4p-Orbitale (n=4). |
Aus der Beschreibung in der Tabelle folgt, dass die Energien der verschiedenen Orbitale mit zunehmender Zahl der Hauptquantenzahl zunehmen.
- Somit ist die Reihenfolge, in der die Elektronen in das Atomorbital eingefüllt werden Atom Ist, 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p…
Elektronische Konfiguration nach dem Aufbau-Prinzip
Der elektronische Konfiguration Die Verwendung des Aufbau-Prinzips für einige Elemente wird im Folgenden erläutert:
Elektronenkonfiguration von Schwefel
Ordnungszahl Die Schwefelzahl beträgt 16, d. h. sie hat 16 Elektronen
Unter Verwendung des Aufbau-Prinzips wird nun die elektronische Konfiguration des Schwefels wie folgt geschrieben:
[S] = 1s 2 2s 2 14 Uhr 6 3s 2 15 Uhr 4
Elektronenkonfiguration von Stickstoff
Die Ordnungszahl von Stickstoff beträgt 7, d. h. er hat 7 Elektronen
Unter Verwendung des Aufbau-Prinzips wird nun die elektronische Konfiguration des Stickstoffs wie folgt geschrieben:
[N] = 1s 2 2s 2 14 Uhr 3
ddl vs. dml
Exceptions of Aufbau Principle
Es gibt einige Ausnahmen vom Aufbauprinzip, nämlich Chrom und Kupfer. Ihre elektronische Konfiguration ist:
Elektronische Konfiguration von Chrom
Die elektronische Konfiguration von Chrom soll nach dem Aufbauprinzip erfolgen
- Cr(24): [Ar]3d 4 4s 2
Die obige Konfiguration ist jedoch nicht korrekt, da die tatsächliche elektronische Konfiguration von Chrom (Cr) wie folgt lautet:
- Cr(24): [Ar]3d 5 4s 1
Der Grund für diese elektronische Konfiguration ist, dass die Das halbgefüllte d-Atomorbital ist stabiler als das nach dem Aufbau-Prinzip gefüllte Orbital.
Elektronische Konfiguration von Kupfer
Die elektronische Konfiguration von Kupfer gemäß dem Aufbau-Prinzip sollte sein:
- Cu(29): [Ar]3d 9 4s 2
Die obige Konfiguration ist nicht korrekt, da die tatsächliche elektronische Konfiguration von Kupfer (Cu) wie folgt lautet:
- Cu(29): [Ar]3d 10 4s 1
Der Grund für diese elektronische Konfiguration ist, dass die Ein vollständig gefülltes d-Atomorbital ist stabiler als das nach dem Aufbau-Prinzip gefüllte Orbital.
Mehr lesen
- Quantenzahlen
- Form von Atomorbitalen
- Atomare Struktur
Aufbau Principle – FAQs
Was ist das Aufbauprinzip in der Chemie?
Das Aufbauprinzip in der Chemie ist das Grundprinzip, das verwendet wird, um die Elektronen in den Atomorbitalen eines beliebigen Atoms zu füllen. Dieser Satz gibt uns die Reihenfolge an, in der die Elektronen im Atomorbital besetzt sind.
Wer hat das Aufbau-Prinzip gegeben?
Das Aufbauprinzip wurde 1920 vom berühmten dänischen Physiker Niels Bohr formuliert.
Was ist Paulis Ausschlussprinzip?
Das Pauli-Ausschlussprinzip besagt, dass in einem Atom keine zwei Elektronen alle vier Quantenzahlen haben T er dasselbe. Zumindest eine der Quantenzahlen ist für alle Elektronen im Atom unterschiedlich.
Was ist die n+l-Regel?
Die n+l-Regel ist die Regel, die besagt, dass die Energie eines Orbitals von der Summe der Hauptquantenzahl (n) und der Azimutquantenzahl (l) abhängt. Diese Regel wird (n+l)-Regel genannt.
Was sind die Ausnahmen vom Aufbauprinzip?
Die Ausnahme vom Aufbauprinzip sind:
- Elektronische Konfiguration von Chrom Cr[24]
- Elektronische Konfiguration von Kupfer Cu[29]
